1. 论文导读
Liu, Bingxu, et al. “Design of high specificity binders for peptide-MHC-I complexes.” bioRxiv (2024): 2024-11.
1)摘要
MHC-I 将胞内抗原肽递呈在细胞表面,用于免疫监视。特异性靶向这些 pMHC 复合物可在治疗疾病方面发挥巨大作用。这种靶向的难点需要读出少数朝外的肽残基,并避免与几乎存在于所有细胞上的 MHC 发生广泛接触。
本文介绍了如何利用基于DL的蛋白质设计工具,从头开始设计出能在 pMHC 复合物的肽结合槽上方呈现弧形并与肽广泛接触的小蛋白质。
研究鉴定了10个 pMHC 靶标的特异性结合剂,它们在酵母展示实验中能与 pMHC 四聚体结合,但不能与密切相关的肽结合。对于五个靶标,将设计结合到嵌合抗原受体中会导致同源 pMHC 复合物对 T 细胞的激活,远高于与来自蛋白组的肽复合物的背景激活。
本文方法可以从靶标 pMHC 复合物的实验结构或预测结构出发,生成高特异性的结合体,应该可以广泛用于基于蛋白质和细胞的 pMHC 靶向。
2)设计流程
设计过程如下:
RFdiffusion:生成蛋白质骨架。将肽的向上(MHC结合沟外面)残基指定为热点。- generate using diffusive denoising
- select based on CMS
- (after the first few targets) partial diffusion to reduce computational cost
ProteinMPNN: 序列设计。AlphaFold2:过滤。
特异性评估:
使用ProteinMPNN评估了每个design-pMHC靶肽的每个氨基酸进行突变的效果。选择肽氨基酸在每个位置上都具有高概率的design,而在每个位置上的替换都会大大降低这种概率。
针对每个靶标,在人类蛋白组中找出了能被靶标 HLA 等位基因递呈的肽。使用经过微调的 AlphaFlod2 模型来预测每个design-目标肽或非目标肽-MHC复合物的结构,并选择预测与目标肽结合(pAE分数较低)的design,其可信度大大高于与非目标肽结合(pAE分数较高)的设计。
3)设计流程的验证
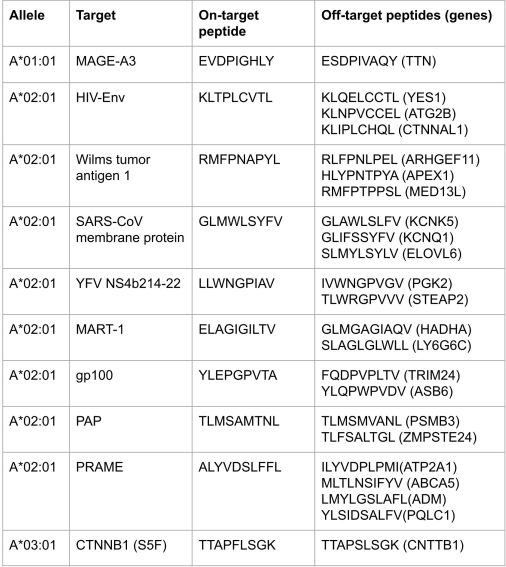
选择10个pMHC靶点(详见下表)验证设计流程的能力。每个靶点分别获取编码 200-12,000 个设计的寡核苷酸库,将设计用酵母展示,用FACS筛出那些能特异性识别靶肽-MHC、而非相关多肽-MHC的寡核苷酸。 通过NGS富集或克隆选择选出TOP设计。
对 7 个 pMHC 复合物使用了从头扩散法,并确定了具有一系列拓扑结构和肽结合界面的设计。对其中 3 个靶标使用了部分扩散方法,从其中一个全新设计开始;再次鉴定出特异的binder。以下将介绍每一类靶标的结果。
对于3个病毒肽(SARS-CoV1, YFV, HIV),设计能将靶肽与密切相关的非靶肽区分开。为了评估这些设计是否能保持作为CAR结合域的特异性,构建了CAR,并将其表达在 Jurkat 细胞表面。并不是所有的 CAR 都能表达,但表达的TOP特异设计都具有特定的 pMHC 结合特征。
接下来评估设计流程靶向各种TAA(WT1, PAP, CTNNb1)的能力。确定了这3种靶肽的设计的特异性。设计模型同样显示肽与设计的结合剂之间存在广泛的相互作用。
为了测试部分扩散方法,从能结合MAGE-A3肽但不能结合非靶的Titin肽的设计开始。从这个支架开始,为其它TAA(gp100, Mart-1)生成了特异性结合剂。此外,还探索了使用预测的 pMHC 结构作为靶点的可能性。PRAME肽复合物的 AF3 预测是有把握的,设计时尝试使用 5 个 AF3 预测结构作为起点。对于这3种靶肽,都发现了与之有广泛而多样的疏水和氢键相互作用的特异性结合剂。
为了评估设计作为可溶性蛋白的表现,在大肠杆菌中表达了 HIV 和 MAGE-A3 粘合剂设计,并使用Ni-NTA色谱纯化。纯化后的设计在SEC中洗脱为与预期尺寸相近的单峰。使用SPR测量了这些设计与其同源 pMHC 的结合情况,发现其结合亲和力在个位数到两位数nM范围内。
评估了这些设计在加入 CAR 后通过 pMHC 激活特异性 T 细胞的能力。为此,将粘合剂加入 CAR 并在 Jurkat 细胞上表达,然后将其与用靶肽或非靶肽处理过的 293T 细胞孵育。在所设计的 MAGE 结合剂中,MAGE-513只在 MAGE-A3 肽的刺激下产生强烈的特异性激活,而在脱靶 Titin 肽或来自 A01:01 细胞内蛋白质组的肽的刺激下则不会产生这种激活。尽管与四聚体有特异性结合,但其他设计的信号要么很弱(MAGE-282),要么有背景激活(hit-4)。
为了进一步确定 MAGE-A3 设计的特异性,用设计探查酵母展示的peptide-A01:01复合物文库,然后测量 MAGE-A3 CAR T 细胞对已鉴定肽段的激活情况,发现前3名激活肽段中有2个与 MAGE-A3 肽段的外向侧链相似。与新结合剂发生交叉反应并激活信号的多肽也具有相似的序列,表明设计流程可以在可预测的范围内对极少数可能序列的子集产生特异性。因此,基于序列相似性对人类蛋白质组中的交叉激活肽进行了第二次扫描。最具有激活作用的多肽在序列上再次与外向残基 I5、H7 和 L8 最为相似,与丙氨酸扫描结果一致。
2. 实战
#to add