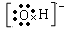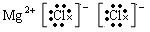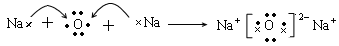一. 原子结构
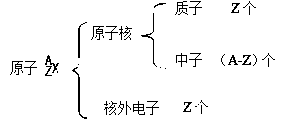
1. 原子核的构成
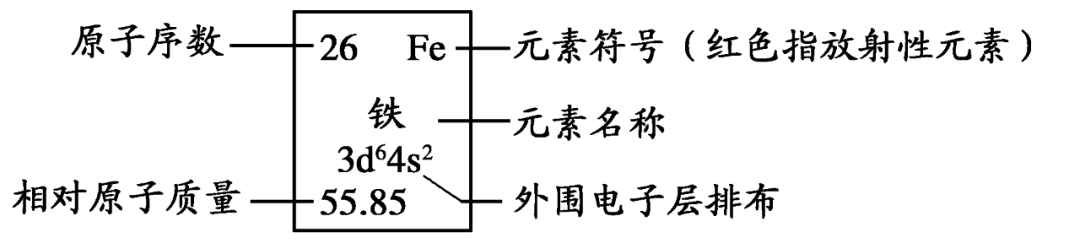
核电荷数(Z) == 核内质子数 == 核外电子数 == 原子序数
2. 质量数:将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。
质量数(A)= 质子数(Z)+ 中子数(N)==近似原子量
3. 原子构成
4. 表示方法
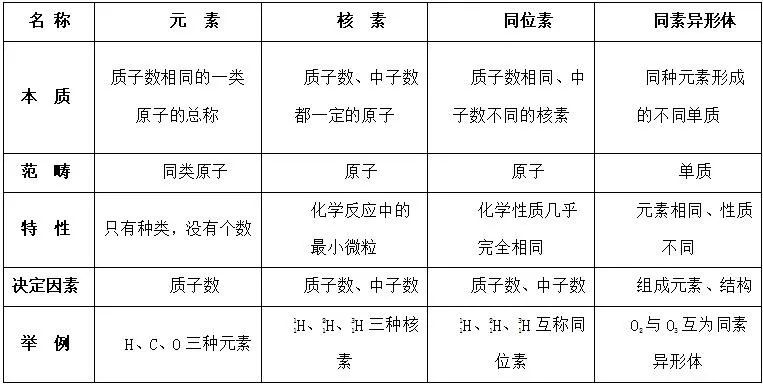
二. 元素、核素、同位素、同素异形体的区别和联系
1. 区别
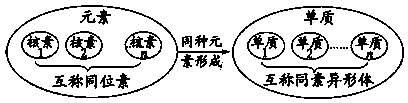
2. 联系
【名师点睛】
(1) 在辨析核素和同素异形体时,通常只根据二者研究范畴不同即可作出判断。
(2) 同种元素可以有多种不同的同位素原子,所以元素的种类数目远少于原子种类的数目。
(3) 自然界中,元素的各种同位素的含量基本保持不变。
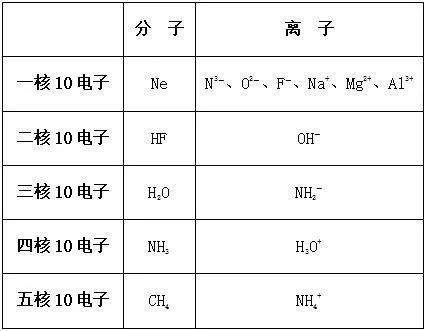
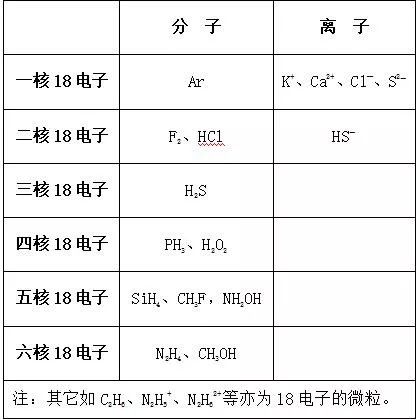
三. “10电子”、“18电子”的微粒小结
1. “10电子”微粒
2. “18电子”微粒
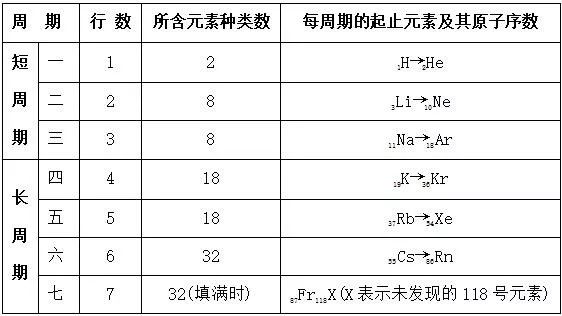
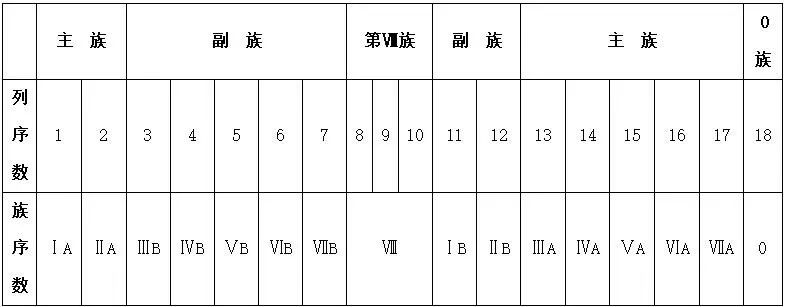
四. 元素周期表的结构
1. 周期
2. 族
3. 过渡元素
元素周期表中从ⅢB到ⅡB共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
特别提醒 元素周期表中主、副族的分界线:
(1) 第ⅡA族与第ⅢB族之间,即第2、3列之间;
(2) 第ⅡB族与第ⅢA族之间,即第12、13列之间。
五. 元素周期表的应用
1. 元素周期表在元素推断中的应用
(1) 利用元素的位置与原子结构的关系推断。
等式一:周期序数=电子层数;
等式二:主族序数=最外层电子数;
等式三:原子序数=核电荷数=质子数=核外电子数。
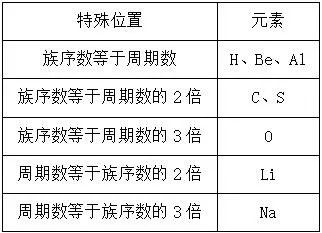
(2) 利用短周期中族序数与周期数的关系推断。
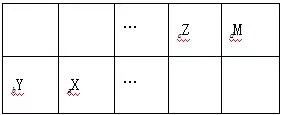
(3) 定位法:利用离子电子层结构相同的“阴上阳下”推断
具有相同电子层结构的离子,如aX(n+1)+、bYn+、cZ(n+1)-、dMn-的电子层结构相同,在周期表中位置关系为
则它们的原子序数关系为a>b>d>c。
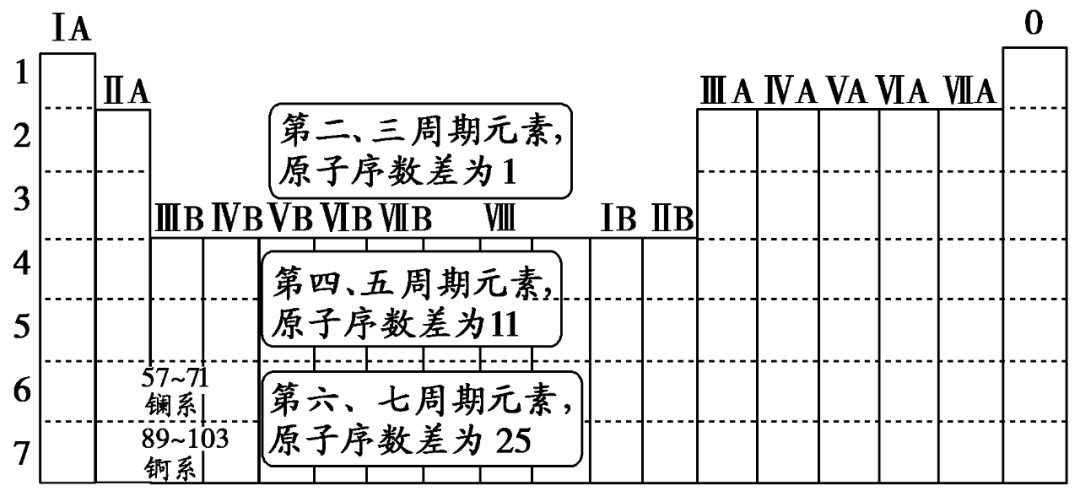
2. 元素原子序数差的确定方法
(1) 同周期第ⅡA族和第ⅢA族元素原子序数差。
(2) 同主族相邻两元素原子序数的差值情况。
① 若为ⅠA、ⅡA族元素,则原子序数的差值等于上周期元素所在周期的元素种类数。
② 若为ⅢA族至0族元素,则原子序数的差值等于下周期元素所在周期的元素种类数。
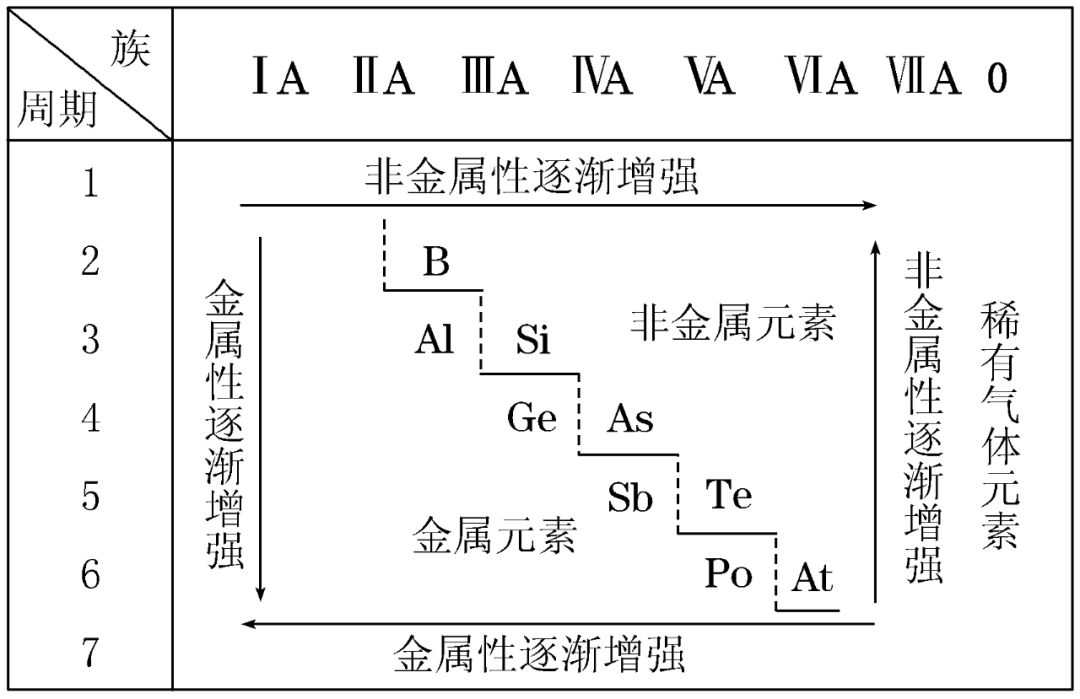
3.启发人们在一定区域内寻找新物质
(1) 半导体元素在金属与非金属分界线附近,如:Si、Ge、Ga等。
(2) 农药中常用元素在右上方,如:F、Cl、S、P、As等。
(3) 催化剂和耐高温、耐腐蚀合金材料主要在过渡元素中找,如:Fe、Ni、Rh、Pt、Pd等。
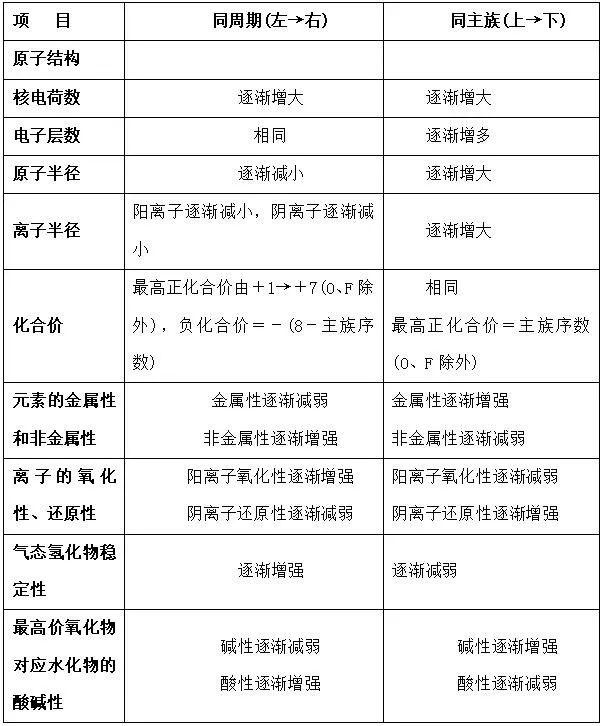
六. 元素周期律
1.定义
元素的性质随原子序数的递增而呈周期性变化的规律。
2.实质
元素原子核外电子排布周期性变化的结果。
3.具体表现形式
1. 周期表中金属性、非金属性之间没有严格的界线。在分界线附近的元素具有金属性又具有非金属性。
2. 金属性最强的元素在周期表的左下角即Cs(Fr具有放射性,不考虑),非金属性最强的元素在右上角即F。
3.元素化合价与元素在周期表中位置的关系。
4.元素周期表和元素周期律对我们的指导作用
① 在周期表中寻找新的农药。
② 在周期表中寻找半导体材料。
③ 在周期表中寻找催化剂和耐高温、耐腐蚀的合金材料。
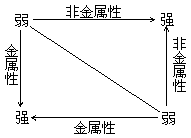
七. 元素金属性、非金属性强弱判断依据
1. 元素金属性强弱判断依据
⑴ 根据常见金属活动性顺序表判断
金属元素的金属性与金属单质的活动性一般是一致的,即越靠前的金属活动性越强,其金属性越强。
需说明的是这其中也有特殊情况,如Sn和Pb,金属活动性Sn﹥Pb,元素的金属性是Sn﹤Pb,如碰到这种不常见的元素一定要慎重,我们可采用第二种方法。
⑵ 根据元素周期表和元素周期律判断
同周期元素从左到右金属性逐渐减弱,如第三周期Na ﹥Mg ﹥Al;同主族元素从上到下金属性增强,如1中所述,Sn和Pb同属Ⅳ主族,Sn在Pb的上方 ,所以金属性Sn﹥Pb。
⑶ 根据物质之间的置换反应判断
通常失电子能力越强,其还原性越强,金属性也越强,对于置换反应,强还原剂和强氧化剂生成弱还原剂和弱氧化剂,因而可由此进行判断。如:Fe + Cu2+ === Fe2+ + Cu 说明铁比铜金属性强。这里需说明的是Fe对应的为Fe2+,如:Zn + Fe2+ === Zn2+ + Fe 说明金属性Zn﹥Fe,但Cu +2Fe3+ === Cu2+ + 2Fe2+,却不说明金属性Cu﹥Fe,而实为Fe﹥Cu。
⑷ 根据金属单质与水或酸反应的剧烈程度或置换氢气的难易判断某元素的单质与水或酸反应越容易、越剧烈,其原子失电子能力越强,其金属性就越强。如Na与冷水剧烈
反应,Mg与热水缓慢反应,而Al与沸水也几乎不作用,所以金属性有强到弱为Na ﹥Mg ﹥Al;再如:Na、Fe、Cu分别投入到相同体积相同浓度的盐酸中,钠剧烈反应甚至爆炸,铁反应较快顺利产生氢气,而铜无任何现象,根本就不反应,故金属性强弱:Na ﹥Mg ﹥Al。
⑸ 根据元素最高价氧化物对应水化物的碱性强弱判断
如从NaOH为强碱,Mg(OH)2为中强碱,Al(OH)3为两性氢氧化物可得知金属性:Na ﹥Mg ﹥Al。
⑹ 根据组成原电池时两电极情况判断通常当两种不同的金属构成原电池的两极时,一般作负极的金属性较强
如Zn和Cu比较时,把Zn和Cu用导线连接后放入稀硫酸中,发现铜片上有气泡,说明锌为负极,故金属性Zn﹥Cu。但也应注意此方法判断中的特殊情况,如铝和铜用导线连接后放入冷浓硝酸中,因铝钝化,铜为负极,但金属性却为Al﹥Cu。
⑺ 根据金属阳离子氧化性强弱判断
一般来说对主族元素而言最高价阳离子的氧化性越弱,则金属元素原子失电子能力越强,即对应金属性越强。
⑻ 根据在电解过程中的金属阳离子的放电顺序判断
放电顺序:Ag+>Hg2+>Cu2+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
在电解过程中一般先得到电子的金属阳离子对应金属的金属性比后得到电子的金属阳离子对应金属的金属性弱,即位置越靠前的对应金属的金属性越弱。如含有Cu2+ 和Fe2+的溶液电解时Cu2+先得电子,所以金属性Fe﹥Cu。其实这一方法同7本质上是一样的。
⑼ 根据金属失电子时吸收能量多少判断
元素原子或离子失去或得到电子时必然伴随有能量变化,就金属元素原子失电子而言,在一定条件下,失电子越容易,吸收的能量越少金属性越强;失电子越难,吸收的能量越多,金属性越弱。如两金属原子X、Y,当它们分别失去一个电子后,都形成稀有气体原子电子层结构X吸收的能量大于Y,故金属性Y>X。
由以上分析可知,在判断金属性强弱时要综合运用各方面知识进行,以防判断时出现偏颇。
2. 元素非金属性强弱判断依据
⑴ 根据元素周期表判断
同一周期从左到右,非金属性逐渐增强;同一主族从上到下非金属性逐渐减弱。
⑵ 从元素单质与氢气化合难易上比较
非金属单质与H2化合越容易,则非金属性越强。如:
F2与H2可爆炸式的反应,Cl2与H2点燃或光照即可剧烈反应,Br2与H2需在200℃时才缓慢进行,而I2与H2的反应需在更高温度下才能缓慢进行且生成的HI很不稳定,同时发生分解,故非金属性F>Cl>Br>I。
⑶从形成氢化物的稳定性上进行判断
氢化物越稳定,非金属性越强。如:H2S在较高温度时即可分解,而H2O在通电情况下才发生分解,所以非金属性O>S。
⑷从非金属元素最高价氧化物对应水化物的酸性强弱判断(F除外,因F无正价)
若最高价氧化物对应水化物的酸性越强,则非金属性越强。
例如:原硅酸(H4SiO4)它难溶于水,是一种很弱的酸,磷酸(H3PO4)则是中强酸,硫酸(H2SO4)是强酸,而高氯酸(HClO4)酸性比硫酸还要强,则非金属性Si
⑸通过非金属单质与盐溶液的置换反应判断
若非金属X能把非金属Y从它的盐溶液或气态氢化物中置换出来,则非金属性X>Y如已知:2H2S + O2 === 2S↓ + 2H2O,则非金属性O>S;另卤素单质间的置换反应也很好的证明了这一点。
⑹ 从非金属阴离子还原性强弱判断
非金属阴离子还原性越强,对应原子得电子能力越弱,其非金属性越弱,即“易失难得”,指阴离子越易失电子,则对应原子越难得电子。
⑺ 从对同一种物质氧化能力的强弱判断
如Fe和Cl反应比Fe和S反应容易,且产物一个为Fe3+,一个为Fe2+,说明Cl的非金属性比S强。
⑻ 根据两种元素对应单质化合时电子的转移或化合价判断
一般来说,当两种非金属元素化合时,得到电子而显负价的元素原子的电子能力强于失电子而显正
价的元素原子。如:S + O2 = SO2,则非金属性O>S。
⑼从等物质的量的非金属原子得到相同数目电子时放出能量的多少判断非金属性强时,放出能量多,非金属性弱时,放出能量少。
综上所述可知,元素的金属性和非金属性与元素得失电子能力以及对应单质或离子的氧化性和还原性有着密不可分的关系,它们可相互推导;这部分内容也是对金属元素和非金属元素知识的整合与提高,一定要详细分析,理解记忆,才能拨开解题时的种种迷雾,得出正确答案。
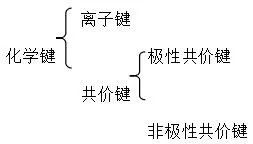
八. 化学键
1. 概念:使离子相互结合或原子相互结合的作用力。
2. 分类
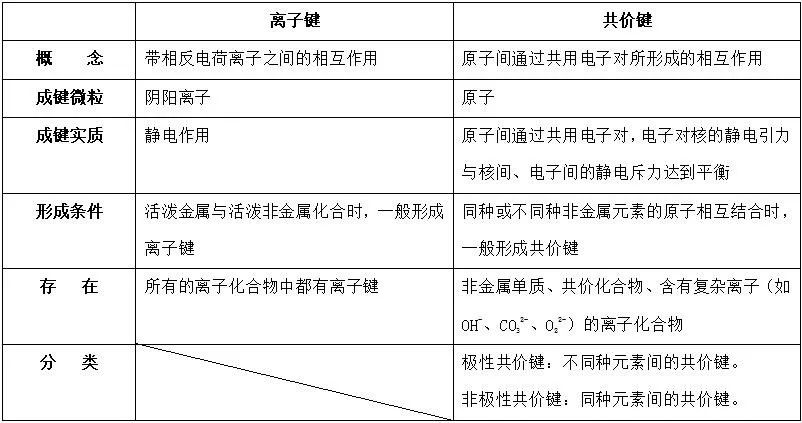
九. 离子键和共价键比较
十. 电子式的书写
1.电子式的概念
在元素符号周围,用“· ”或“×”来表示原子的最外层电子的式子叫电子式。
(1)原子的电子式:元素周围标明元素原子的最外层电子,每个方向不能超过2个电子。当最外层电子数小于或等于4时以单电子分步,多于4时多出部分以电子对分布。例如:
(2)简单阳离子的电子式:简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示,如:Na+、Li+、Mg2+、Al3+等。
(3)简单阴离子的电子式:不但要画出最外层电子数,而且还应用括号“[ ]”括起来,并在右上角标出“n-”电荷字样。例如:氧离子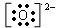
(4)多原子离子的电子式:不仅要画出各原子最外层电子数,而且还应用括号“[ ]”括起来,并在右上角标出“ n-”或“n+电荷字样。
例如:铵根离子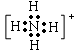
(5)离子化合物的电子式:每个离子都要单独写,而且要符合阴阳离子相邻关系,如MgCl2要写成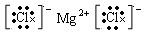
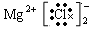
2.用电子式表示离子化合物的形成过程
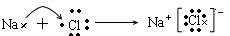
例如:NaCl的形成过程:
Na2O的形成过程:
CaBr2的形成过程:
【名师点拨】用电子式表示离子化合物的形成过程是要注意:
①连接符号必须用“→”而不用“=”。
②左边相同的原子的电子式可以合并,但右边构成离子化合物的每个离子都要单独写,不能合并。
十一. 分子间作用力、氢键
1. 分子间作用力
⑴ 概念:分子之间存在一种把分子聚集在一起的作用力叫做分子间作用力。
⑵ 特点:
① 分子间作用力比化学键弱得多,它主要影响物质的熔沸点、溶解度等物理性质,而化学键主要影响物质的化学性质。
② 分子间作用力存在于由共价键形成的化合物分子之间,和绝大多数气态非金属单质分子之间。
⑶ 变化规律:一般来说,对于组成和结构相似的由分子构成的物质,相对分子质量越大,分子间作用力也越大,物质的熔沸点也越高。例如:I2>Br2>Cl2>F2。
2. 氢键
⑴ 概念:与电负性很大的原子形成共价键的原子与另一个电负性很大的原子之间的作用力。
⑵ 形成条件:除H原子外,形成氢键的原子通常是N、O、F。
⑶ 存在作用:分子间氢键会使物质的熔点、沸点升高。
资源下载:
01. 2019年高考各套化学试题和各地模拟题分类汇编
02. 三年高考(2017-2019)化学题分类汇编
03. 高中化学必备1000个flash动画
04. 高中化学学业水平考试复习课件
05. 2019高考全部九套试卷化学题答案+解析
06. 2019全国各地中考化学试卷(共180份打包)
07. 九年级化学说课稿、教案、导学案(上下册全套)
08. 高中化学公开课大赛课件、教学设计
09. 台湾地区高考近十年化学试卷分享
10. 初高中化学衔接资料合集(教材+作业+学案+实验+课件)
11. 高中化学必修1、2+选修4说课稿、课件等
12. 2020届高考化学一轮复习课件学案练习课件(两套)
13. 各地2019届高三4月理综化学模拟卷精选
14. 各地2019届高三5月理综化学模拟卷精选
15. 各地2019届高三3月理综化学模拟卷精选
16. 2018全国同课异构总决赛高中化学冠军赛课件
17. 高中化学选修 + 必修共七册全部教案
18. 高中化学教材全部实验和模型视频!
19. 高中化学三版本各模块全套电子课本
20. 微课制作从基础到进阶视频教程