这本由日本人吉田隆嘉撰写的《走进奇妙的元素周期表》是一本很有趣的关于元素周期表的书。
元素周期表是一个很精妙的发明。它其实不按照我们习惯的顺序从左往右看,而是一个需要从两头往中间看的存在。
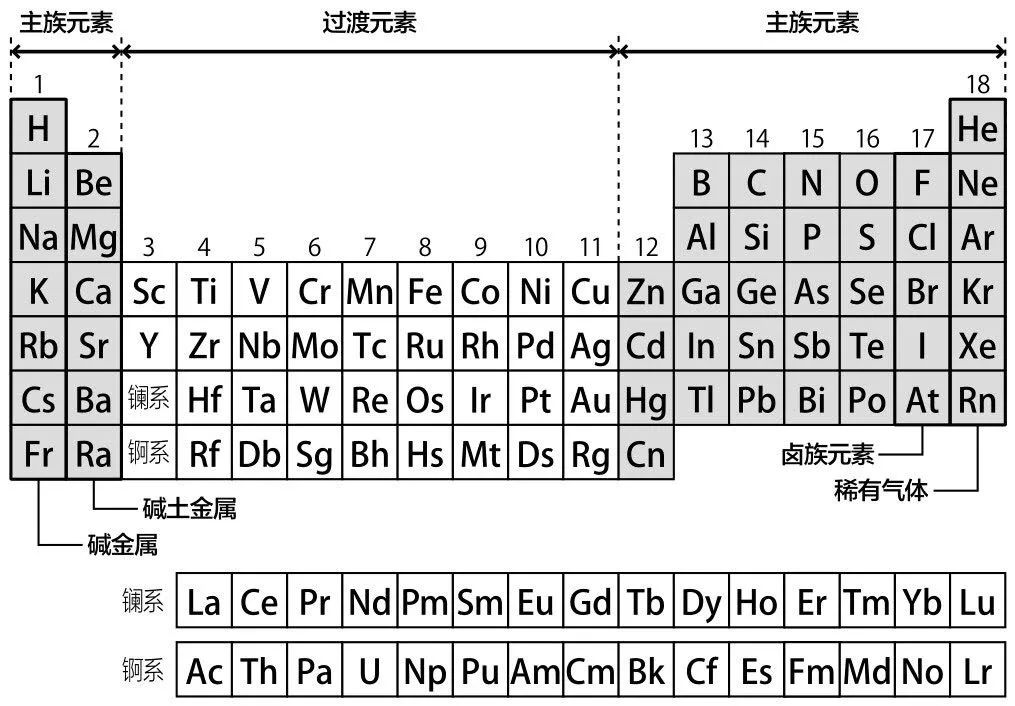
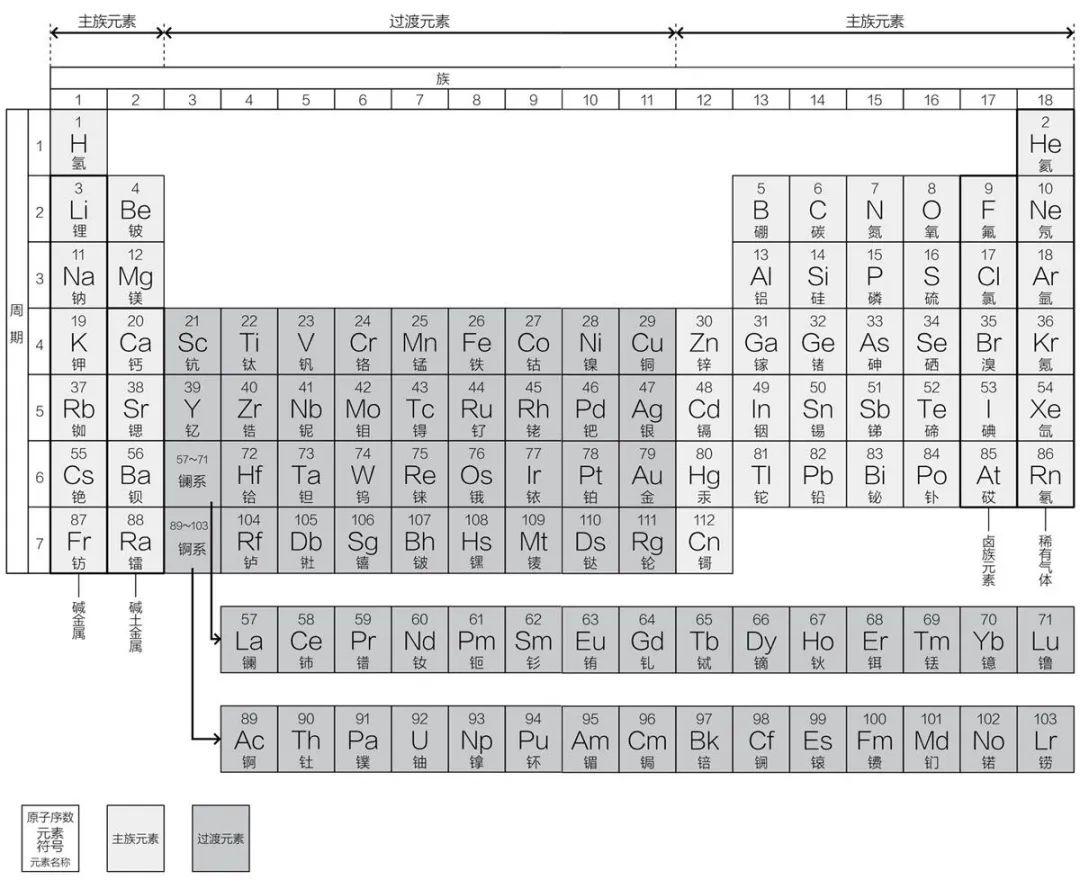
第1列到第2列,以及第12列到第18列被称为“主族元素”。
第3列到第11列被称为“过渡元素”。过渡元素的纵向联系并不紧密,但位于同一行的元素性质相近,每往右移一格就会有些许变化。
属于同一列的元素最像的有下列四个族(相似度由高到低):
第18列(稀有气体)
第1列(碱金属)
第17列(卤族元素)
第2列(碱土金属)
原子核周围并没有恒定的“轨道”,只有“电子的存在概率”。
元素的电子一般都是由内向外排布。
周期表上同属一列的元素,最外层电子的状态往往非常相似。
最外层电子数决定了元素的基本性质。
把内侧的轨道填满后,剩余的电子就会分布到最外层的轨道上。而同一列元素的“残余电子”数量往往相同,所以同一列的元素常具有相似的特性。
比如人体会把外层电子数相同的铯误认为钾,把锶误认为钙。
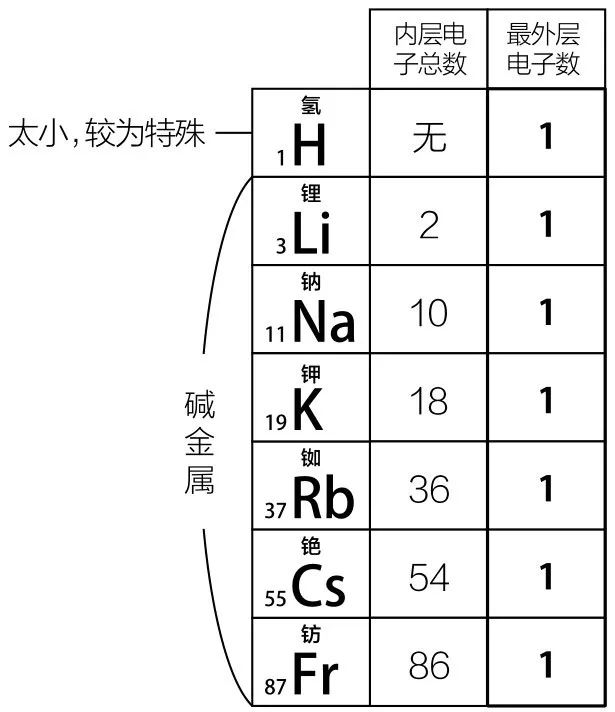
以第一列碱金属为例,它们的最外层电子数是一样的:
它们很容易失去最外围的那个电子,形成+1价的阳离子,其他化学性质也非常相似。除了氢,它们都是金属,但是能溶于水,形成碱性溶液,因此被称为碱金属。
元素周期表的行被称为“周期”。
氢和氦是第1周期。
包括碳、氮等的第2行是第2周期。
包括钠、铝等的第3行是第3周期。以此类推。
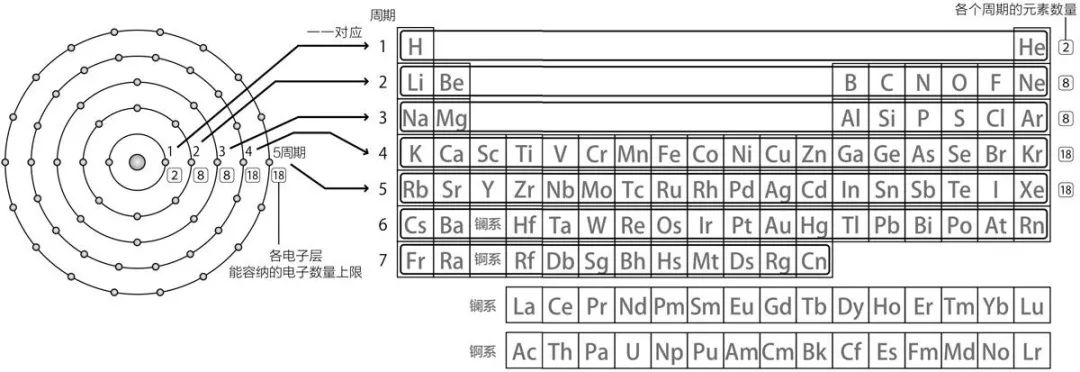
每一行元素轨道数量与该行序数一一对应。比如第一行是第一周期,这些元素有一条电子轨道。第二行是第二周期,这些元素有两条电子轨道。
每一行元素的数量其实与这行元素电子轨道能容纳的最大电子数量一一对应。
比如第一行有两个元素,这行元素的这一层电子轨道上的电子数量的上限是两个。
第二行的元素有两条电子轨道。这行有八个元素,这意味着这行第二层电子轨道上的电子数量的上限是八个。第一层电子轨道上的电子数量上限依然是两个,因此第二行(第二周期)的电子数量上限是十个。
第三行的元素有三条电子轨道。这行也有八个元素。这意味着这行第三层电子轨道上的电子数量的上限也是八个。第一第二层的电子数量上限依然是两个和八个,因此第三行(第三周期)的电子数量上限是十八个。
以此类推。
只要掌握解读周期表的方法,我们对宇宙的理解就会有飞跃性的提升。
天然元素几乎都无法在地球上形成。组成人体的元素大多来源于宇宙。元素的诞生有一项至关重要的条件——温度一定要超过一千万度。这样的高温一般来源于:
1. 形成宇宙的“大爆炸”
2. 在太阳等恒星内部的“核聚变”
3. 恒星死亡时的“超新星爆炸”
值得一提的是: 猎户座的参宿四随时都有可能发生超新星爆炸,可能是明天,可能是一百万年以后。这将是智人诞生20万年以来规模最大的天体秀。届时元素的进化就会再次发生。
待续。